《化学考试说明》分析
——基本概念、理论;物质结构与性质
南陵中学 王玉
尊敬的各位领导、专家、同仁:
大家好!我分析的是基本概念、理论和物质结构与性质。讲得不足之处请大家批评指正。
初步统计,中学化学所涉及的概念及理论大大小小共有200多个,它们构建了中学化学的基础。化学基本概念与基本理论是化学的最基本内容与最基础的知识,也是学习的难点,学生的分化点,更是高考的重点(准确的说是重中之重)。安徽省2011年《考试说明》化学基本概念和基本理论这块分了8个方面,它们分别是:
1.物质的组成、性质和分类
2.化学用语及常用计量
3.溶液
4.物质结构和元素周期律
5.化学反应与能量
6.化学反应速率和化学平衡
7.电解质溶液
8.以上各部分知识的综合应用。
其中能力层次要求掌握(熟记)的有16条,要求了解的为39条。今年删除了解测定溶液pH的方法。
我们说基本概念、基本理论,是形成能力的载体,也是考查的重中之重,高考怎么考呢?所占的比重如何呢?下面我们看看安徽省自主命题的两年,2009年和2011年理综试题化学部分基本概念、基本理论各知识点的命题统计情况。
2010年安徽理综(化学)基本概念、基本理论各知识点的命题统计情况
题号 | 考察知识点 | 分值 |
7 | 元素的性质、氧化还原反应的基本概念 (亚氨基锂是一种储氢的材料) | 6 |
9 | 离子共存 | 6 |
10 | 化学平衡 (处理废气中的氮氧化物) | 6 |
11 | 原电池 (氢氧固体酸燃料电池) | 6 |
13 | 电解质溶液中微粒浓度的关系 | 6 |
25 | 元素周期表、周期律、物质结构、热化学 | 9 |
27 | 离子反应 | 5 |
28 | 离子反应、氧化还原反应探究 | 6 |
2009年安徽理综(化学)基本概念、基本理论各知识点的命题统计情况
题号 | 考察知识点 | 分值 |
7 | 同位素、物质的量 (石墨烯为载体,正确复述、再现、辨认的要求) | 6 |
10 | 离子共存 | 6 |
11 | 化学平衡 (图像的形式呈现) | 6 |
12 | 电解池 (氧化亚铜) | 6 |
13 | 电解质溶液中微粒浓度的关系 | 6 |
25 | 元素周期表、周期律、物质结构、热化学 | 14 |
27 | 离子反应、计算和实验操作 | 4 |
28 | 化学平衡、实验操作、探究 (化学反应速率) | 2 |
我们从表中可以看出2009年和2011年安徽省自主命题的两年中基本概念和基本理论的分值都达到了50分。(其中包含了基本概念和基本理论在其它题型中考查的形式)施行新课改后,试题更趋于回归基础、回归教材,化学试题以考查能力为起点,注重考查基础知识、基本技能和基本方法,突出主干知识。
那么通过2009年和2010年的两年高考我们可以总结到哪些考试热点呢?
一 离子方应、离子大量共存问题(两年都有考查)
9.(2010-安徽)在pH=1的溶液中,能大量共存的一组离子或分子是()
A.Mg2+、Ca2+、ClO-、![]()
B.Al3+、![]() 、Br-、Cl-
、Br-、Cl-
C.K+、Cr2O![]() 、CH3CHO、(出现有机分子)
、CH3CHO、(出现有机分子)![]()
D.Na+、K+、![]() 、Cl-
、Cl-
10(2009-安徽)在溶液中能大量共存的一组离子或分子是( )
A.![]() 、
、![]() 、
、![]() 、
、![]()
B.K+、Al3+、![]() 、NH3·H2O
、NH3·H2O
C.Na+、K+、![]() 、Cl2
、Cl2
D.Na+、CH3COO-、![]() 、OH-
、OH-
不难发现两年都考了氧化还原反应等。
离子反应2010年考查的是:4 LiMn2O4+ 4H++ O2== 8MnO2+ 4Li++ 2H2O
(27题第(2)问)
Fe3++ Ag = Fe2++ Ag+ (28题第(1)问)
2009年考查的是:Cr2O72- + 6Fe2++ 14H+![]() 2Cr3+ + 6Fe3++ 7H2O(27题第(1)问)
2Cr3+ + 6Fe3++ 7H2O(27题第(1)问)
课本上没有具体讲氧化还原反应的配平,但是考试的时候,简单的配平还是要求会写的。考试说明中明确提出要求掌握方程式的配平。第5条的第(1)点。
二 化学平衡
11.(2009-安徽)汽车尾气净化中的一个反应如下:
![]()
![]()
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:

10.(2010-安徽)低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:
2NH3(g) + NO(g)
![]() 2N2(g) + 3H2O(g) ΔH<0
2N2(g) + 3H2O(g) ΔH<0
在恒容密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
涉及的知识点有:化学平衡常数、转化率、化学平衡的影响因素等。
同时2009年第28题也考查了化学反应速率等相关知识。
三 电化学
12.(2009-安徽)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O![]() 。下列说法正确的是( )
。下列说法正确的是( )
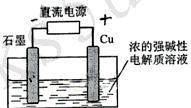
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
11.(2010-安徽)某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+ O2== 2H2O,下列有关说法正确的是( )
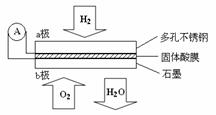
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+ 2H2O + 4e- == 4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
涉及的知识点有:正负极的判断、电极反应式、电子转移的数目等
四 电解质溶液
13.(2009-安徽)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是( )
A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B. Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
C. Va
D. Va与Vb任意比时:c (K+)+ c (H+)=c (OH-)+ c (CH3COO-)
13.(2010-安徽)将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③>④ D.①=②>③=④
涉及的知识点有:溶液中离子浓度大小比较、三大守恒等
五 其他热点
1.掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
2.正确书写化学方程式、热化学方程式、离子方程式、电离方程式、电极方程式。
3.阿伏加德罗常数的含义、气体摩尔体积。
4.元素周期律、元素周期律表
5.物质的量与微粒数目、气体体积之间的相互关系进行有关计算。
6.了解“四同”的含义
7.理解化学平衡常数的含义,并能简单计算。
8.能判断氧化还原反应中电子转移的方向、数目,并能配平反应方程式。
2009年和2010年都考查了,利用盖斯定律书写热化学方程式。我想2011年可能会继续考。
第二部分 《物质结构与性质》模块
一 《考试说明》中的要求(2条6点)
1.原子结构与元素的性质
(1)了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。了解原子核外电子的运动状态。
(2)了解电离能的含义,了解同一周期、同一主族中元素电离能的变化规律。
(3)了解电负性的概念,知道元素的性质与电负性的关系。
(1)了解共价键的主要类型((σ键和π键)。能用键能、键长、键角等说明简单分子的某些性质。
(2)了解极性键和非极性键。
(3)分子晶体、原子晶体、离子晶体和金属晶体的结构微粒及微粒间作用力的区别。[z2]
二 高考热点
1.原子核外电子排布式的书写。
2010年考的是铁,2009年考的是硫
2.第一电离能
2009年考了硫和铝的第一电离能的比较,也考查了轨道的概念。
3.电负性
4.σ键和π键
2010年考查了σ键和π键的个数、键长等概念。
5.新增部分
分子晶体、原子晶体、离子晶体和金属晶体的结构微粒及微粒间作用力的区别。(增加的内容)
怎么考呢?题型示例第27题是2010年25题改编来的,增加了一道题目即第(3)问。
(3)W元素氧化物的晶体类型为 ,其熔点比Y晶体 (填“高”、“低”、或“无法确定”)。
第三部分 复习策略
一 注重基础,回归课本
二 突出迁移,深入理解
三 联系实际,强调应用
四 重视能力,注重强化
五 类比辨析、掌握本质
六 把握热点、重点突破
谢谢大家!